Mineralogía - Cristalografía
Bases químicos
La estructura cristalina, y por lo tanto también las características físicas y químicas del cristal,dependen de
- los componentes químicos que lo forman (composición química)
- la naturaleza de los componentes (átomos, iones, moléculas)
- la disposición geométrica de los componentes
- la naturaleza de los enlaces que los unen
Entre los enlaces químicos presentes en los cristales se diferencia enlaces covalentes, iónicos y metálicos, además de fuerzas Van der Waals (fuerzas atractivas o repulsivas entre moléculas).
Enlace covalente
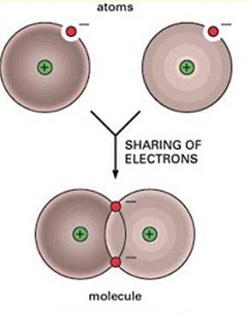
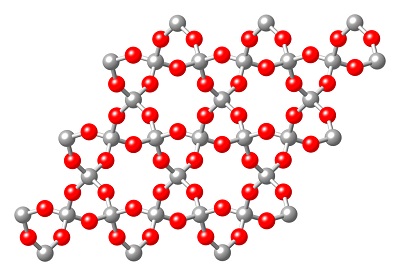
Dos o más átomos con enlace covalente comparten los electrones de su capa externa. Cristales con enlace covalente por lo general son duros y malos conductores térmicos y eléctricos (excepto el Diamante que es buen conductor térmico) y poseen puntos de fusión altos. Un buen ejemplo de un cristal de este tipo es el Cuarzo (SiO2).
 |
 |
|
Principio
de un enlace covalente (87)
|
Estructura
covalente compleja, ejemplo Cuarzo (88)
|
Enlace iónico
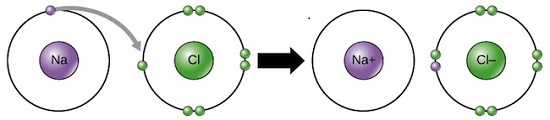
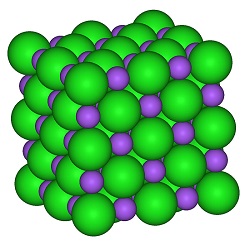
El enlace ionico resulta de las interacciones electrostáticas entre iones de cargas opuestas. En forma simplificada, un atomo entrega un electron de su capa externa (convirtiendose en un ión de carga pósitiva) y otro recibe el eléctron (convirtiendose en un ion de carga negtiva). Cristales con enlaces iónico por lo general son quebradizos, frecuentemente duros (aún que existen muchos ejemplos de metales relativamente blandos), malos conductores térmicos y eléctricos y poseen puntos de fusión altos. Un buen ejemplo es la Halita (cloruro de sodio, NaCl). En más del 90% de los minerales el enlace iónico es por lo menos predominante
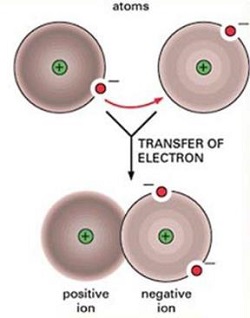 |
|
|
Principio
de un enlace ionico (89)
|
Enlace
ionico, ejemplo Halita (90),
(91)
|
Enlace metálico
El enlace metálico se caracteriza por núcleos de átomos separados de sus electrones. Los átomos (de carga positiva) se unen por electrones que son relativamente libres de moverse a través de la estructura tridimensional. Cristales con enlaces metálicos varían de duros a blandos (por lo general tienen baja dureza). Se caracterizan por su plasticidad, ductilidad y maleabilidad. Son buenos conductores térmicos y eléctricos. Poseen puntos de fusión variables, por lo general bajos. El enlace metálico es típico para los: metales nativos y metales / aleaciones metálicas en general.
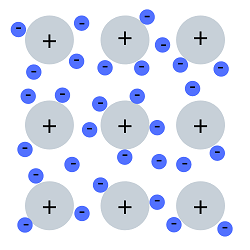 |
|
Esquema
de enlace metálico típico para metales nativos y
aleaciones (92)
|
Combinaciones de enlaces en el mismo cristal
Muchos cristales presentan un solo tipo de enlace, pero en la gran mayoría se combinan varios enlaces. Una combinación del enlace iónico con el enlace covalente en el mismo cristal es frecuente, como demuesra la figura siguiente del ejemplo de la Calcita (CaCO3). El ion Ca2+ se combina con el complejo iónico (CO3)2-, que a la vez es una molécula de carbono y oxígeno, con enlace covalente.
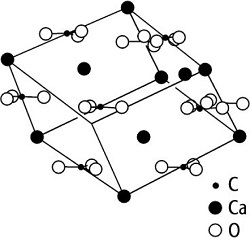 (93)
(93)